

Ciencias Naturales - Química Inorgánica
Ciencias Naturales - Química Inorgánica
2.5 La Tabla Periódica de los Elementos Químicos
La tabla periódica o sistema periódico organiza a todos los elementos químicos en orden creciente de su número atómico.
La tabla periódica es tal vez una de las interpretaciones más importantes y significativas que los químicos y físicos han realizado para el avance de la ciencia. En ella se representan todos los elementos químicos que se conocen hasta hoy. Los elementos químicos se han descubierto poco a poco a lo largo de la historia. Hasta el año 1700, solo se conocían 12 elementos, y en 1830 se habían identificado 55. La mayoría se descubrieron durante el siglo XIX, pero la lista se completó a lo largo del siglo XX y lo recorrido del siglo XXI. Actualmente, están identificados 118 de los cuales 92 se encuentran formando compuestos en la naturaleza y el resto han sido sintetizados en el laboratorio.
2.5.1 Antecedentes del sistema periódico de los elementos
Uno de los retos químicos de finales del siglo XVIII fue el de clasificar los elementos de acuerdo con propiedades en común. Así, los elementos conocidos hasta el momento se agrupaban en metales como el hierro, la plata o el cobre, y no metales, como el fósforo, el oxígeno y el azufre. Sin embargo, algunos otros como el arsénico o el germanio no se ajustaban claramente a una de estas dos categorías, por lo que se podía hablar de elementos semimetálicos. Esta clasificación era demasiado general y por eso continuaron investigando otra forma de organizados utilizando criterios más restringidos. Entre estos intentos de clasificación se destacan los trabajos de Döbereiner, Newlands, Mendeleiev y Meyer.
Tríadas de Döbereiner: En 1829, el químico alemán Johann W. Döbereiner (1780-1849) observó que había grupos de tres elementos que tenían propiedades físicas y químicas muy parecidas o mostraban un cambio gradual en sus propiedades. Con base en sus observaciones clasificó los elementos en grupos de tres y los llamó triadas. Mostró también que el peso atómico del elemento central de cada triada era aproximadamente el promedio aritmético de los pesos de los otros dos.




Octavas de Newlands: En 1864, el inglés Johan Alexander Newlands (1838-1889) ordenó los elementos conocidos de acuerdo con sus pesos atómicos crecientes; observó que después de ubicar siete elementos, en el octavo se repetían las propiedades químicas del primero (sin tener en cuenta los gases nobles). Newlands llamó a esta organización la ley de las octavas; de esta manera quedaron en el mismo grupo (columna), el litio (Li), el sodio (Na) y el potasio(K); el berilio (Be), el magnesio (Mg) y el calcio (Ca); el oxígeno (O) y el azufre (S), etc., que tienen propiedades similares. Gracias a sus observaciones, Newlands ordenó los elementos en grupos y períodos, pero este ordenamiento presentó un problema: mientras algunos grupos tenían elementos con propiedades muy parecidas, otros tenían elementos con propiedades completamente diferentes.
La tabla periódica de Mendeleiev: En 1869, los químicos Ivanovich Dimitri Mendeleiev (1834-1907) y Lothar Meyer (1830-1895) publicaron por separado tablas periódicas prácticamente coincidentes, en las que clasificaban los 63 elementos conocidos hasta esa fecha (entre 1830 y 1869 se descubrieron ocho nuevos elementos). La clasificación de Mendeleiev hacía especial énfasis en las propiedades químicas de los elementos; mientras Meyer hacía hincapié en las propiedades físicas.
Mendeleiev fue el primero en dar a conocer su tabla periódica, organizó los elementos en orden creciente de sus pesos atómicos en filas y columnas de modo que los elementos que quedaban en la misma columna tenían propiedades semejantes. Lo ingenioso de la idea de este científico era que las filas no tenían todas la misma longitud, pero en cada una de ellas existía una analogía gradual de las propiedades de
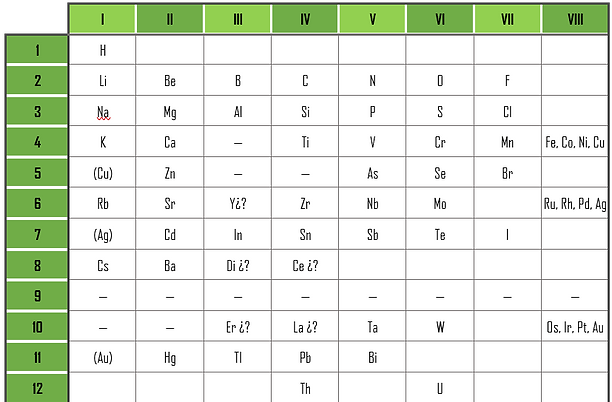
los elementos. Por otro lado, no dudó en dejar espacios en la tabla, en invertir elementos e incluso llegó a predecir con éxito las propiedades de los elementos que algún día ocuparían los espacios vacíos. Mendeleiev resumió su descubrimiento estableciendo su ley periódica, que dice:
Las propiedades de los elementos químicos no son arbitrarias, sino que varían con el peso atómico de una manera periódica.
El sistema periódico de Mendeleiev, no obstante, presentaba algunas fallas. Por ejemplo, cuando años más tarde empezaron a descubrirse los gases nobles y ubicarse en su sitio, resultó que el argón (Ar), tenía un peso atómico superior al del potasio (K), mientras que los restantes gases nobles tenían pesos atómicos inferiores a los elementos siguientes. Era evidente que no resultaba totalmente aceptable el aumento de peso atómico como referencia para ubicar los elementos en el sistema periódico.
La tabla periódica moderna: En 1913, Henry G. J. Moseley (1887-1915) sugirió que los elementos se ordenaran de acuerdo con el orden creciente de su número atómico. Al hacer este planteamiento se solucionaron varios problemas que presentaba la tabla de Mendeleiev. A partir de estas evidencias, Moseley propuso una nueva tabla y enunció la ley periódica moderna:
“Las propiedades físicas y químicas de los elementos varían en forma periódica según el orden creciente de sus números atómicos”.